東工大ニュース

東工大ニュース
公開日:2024.01.16
東京工業大学 科学技術創成研究院 生体恒常性研究ユニットの松田隆志特任助教、野田昌晴特任教授らの研究グループは、生物の水分欲求および塩分欲求を一過性に抑制する2種類の神経細胞を発見し、その働きを初めて明らかにした。水分および塩分を摂取したとき、後脳にある外側腕傍核(LPBN)[用語1]においてコレシストキニン(Cck)[用語2]遺伝子を発現する2種類の神経細胞(Cckニューロン)が活性化すること、その結果、水分?塩分欲求が一過性に抑制されることが分かった。水分摂取に応答するCckニューロンの集団は正中視索前核(MnPO)の抑制性神経細胞(GABAニューロン)[用語3]の活動を、塩分摂取に応答する集団は腹側分界条床核(vBNST)のGABAニューロンの活動を、それぞれ一過性に活性化していることが分かった。
本研究グループでは、これまでに脳弓下器官(SFO)において体液の状態に応じて水分および塩分欲求の制御をつかさどる神経細胞(水ニューロン[用語4]および塩ニューロン[用語5])を同定し、体液状態に応じてこれらの神経細胞が制御される詳細な仕組みを報告していた[参考文献1、2]。SFOの水ニューロンはSFO内のCckニューロンによって制御されること[参考文献3]、また、水ニューロンはMnPOに、塩ニューロンはvBNSTに連絡していることを明らかにしていた[参考文献2]。今回の研究成果と併せて、水分欲求および塩分欲求の制御をつかさどるシグナルは、それぞれMnPOおよびvBNSTで集約?統合されること、SFOとLPBNからのシグナルは協調的に水分欲求を抑制していることが分かった。本研究成果は、生物が体液状態を生理的レベルに保つための仕組み(体液恒常性の維持機構)を明らかにしたものであり、水中毒や多飲症、食塩感受性高血圧症などの過剰な水分摂取や塩分摂取により誘発される疾患の発症機序解明に貢献するものと期待される。
本研究成果は米国の科学誌「Cell Reports(セル リポーツ)」に12月28日付けでオンライン掲載された。
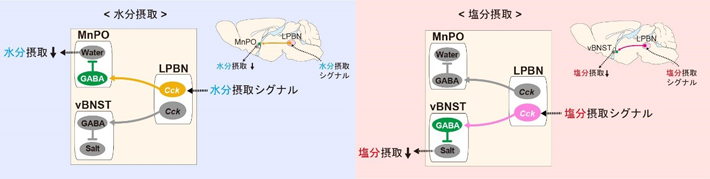
水分摂取および塩分摂取を抑制するフィードバック制御機構
ヒトを含む脊椎動物において、水分や塩分の摂取を適切に制御することは生命維持にとって非常に重要である。過剰な水分摂取や塩分摂取はさまざまな疾患の原因となり、脳を含む多くの臓器に致命的な障害を発生させる。脳は、基本的に体液中の水分や塩分の過不足を感知して、水分欲求や塩分欲求を制御している。これに加えて、水分や塩分を摂取した際に、摂取の情報は舌や消化器官で感知され、吸収されて体液状態が変化する前に一時的に更なる摂取を抑制制御する仕組みを備えている。しかしながら、その詳細なメカニズムは明らかになっていなかった。
後脳にある外側腕傍核(LPBN)はさまざまな種類の遺伝子を発現している神経細胞で構成されており、末梢と中枢(脳)の情報伝達に関わる「中継地点」の役割を果たしている。すなわち、末梢から中枢への味覚や食欲、体温、痛覚、心肺機能、呼吸などに関わる情報伝達が、LPBNの神経細胞を介して行われている。これまでに、LPBNにおけるCckニューロンの一部は摂食制御や体温調節に関わることが知られていたが、水分摂取や塩分摂取の制御に関与しているか、また関与しているとしても、どのような仕組みで関与しているのかという点については分かっていなかった。
本研究では、まず遺伝子改変マウス(Cck -Creマウス)とアデノ随伴性ウイルスベクター[用語6]を組み合わせてLPBNのCckニューロンを標識した。次に、さまざまな体液状態におけるCckニューロンの活動を神経細胞の活性化マーカーであるFosを指標にして解析した。Fosの発現の増加から、LPBNにおいて主に背側および外側に存在するCckニューロン(興奮性神経細胞の1つ)が水分摂取や塩分摂取に応じて活性化してくることが分かった。
次に、生きたマウスの脳内で、in vivoカルシウムイメージング[用語7]によって水分摂取時や塩分摂取時におけるLPBNのCckニューロンの活動を経時的に観察した。その結果、LPBNのCckニューロンの中には、水分摂取のみに応答する集団(Group A)と塩分摂取のみに応答する集団(Group B)、さらに、いずれにも応答しない集団(Group C)が存在することを発見した(図1)。Group Aの活動は水分摂取開始から約25秒で最大になる一方で、Group Bの活動は塩分摂取開始から約5秒で最大になることが分かった。この時間差の生じる原因は、水分摂取のシグナルが消化管から伝達されるのに対し、塩分摂取のシグナルは舌の味覚として伝達されることに起因していると考えられる。実際に、舌の塩味の受容体である上皮性ナトリウムチャネル(ENaC)の機能を阻害剤で抑制したところ、塩分摂取時におけるGroup BのCckニューロンの活動が抑制された。
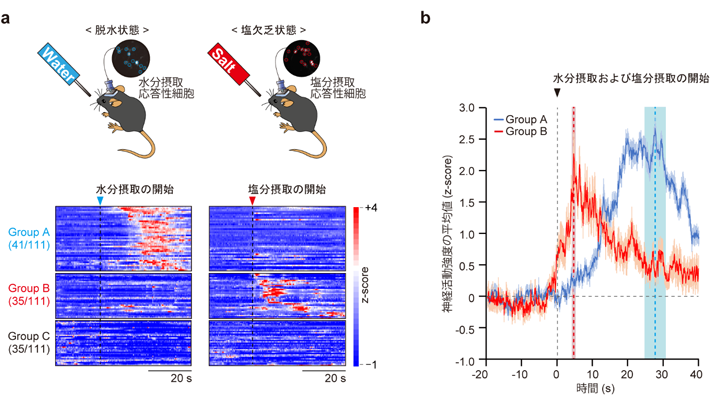
図1. それぞれ水分摂取および塩分摂取に特異的に応答するLPBNの異なるCckニューロン集団。
a. 水分摂取および塩分摂取に対する応答性からCckニューロンは3つの集団に分類された。 b. 水分および塩分摂取に対するGroup Aと Group Bの応答性。
次に、Cckニューロンから脳内にどのような経路で水分?塩分摂取に関する情報が伝達されているのか明らかにするために、Cckニューロンを標識してその神経軸索が投射している領域を探索した。その結果、正中視索前核(MnPO)につながるCckニューロンの集団(LPBNCck→MnPOニューロン)および腹側分界条床核(vBNST)に連絡しているCckニューロンの集団(LPBNCck→vBNSTニューロン)がいずれもLPBNの背側領域にあることを見出した。オプトジェネティクス[用語8]の技術を用いて、LPBNCck→MnPOニューロンを活性化したところ、水分摂取が選択的に抑制されることが分かった。同様にLPBNCck→vBNSTニューロンを活性化したところ、塩分摂取が選択的に抑制された(図2)。以前の研究成果[参考文献2]と合わせて、脳弓下器官(SFO)の水分欲求を制御するシグナルとLPBNの水分欲求を抑制するシグナルは、どちらもMnPOに伝達されており、SFOの塩分欲求を制御するシグナルとLPBNの塩分欲求を抑制するシグナルは、いずれもvBNSTに伝達されていることが明らかになった。
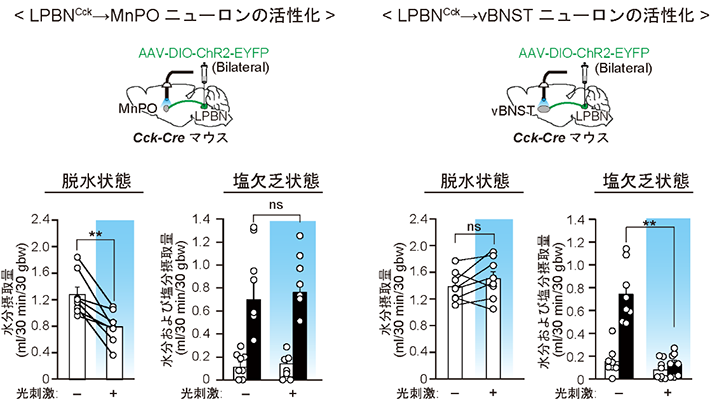
図2. LPBNのCckニューロンの活性化による水分摂取および塩分摂取の抑制。
上図: MnPOへ連絡するCckニューロンおよびvBNSTへ連絡するCckニューロンの光活性化。 下図: Cckニューロンを活性化した際、しなかった際の水分?塩分摂取量の違い。
さらに、オプトジェネティクスとin vivoカルシウムイメージングを組み合わせて用いることによって、LPBNCck→MnPOニューロンあるいはLPBNCck→vBNSTニューロンはいずれもGABAニューロンに連絡しており、それらのGABAニューロンの活性化は水分摂取あるいは塩分摂取に応答することを明らかにした(図3)。また、オプトジェネティクス技術を用いてMnPOおよびvBNSTのGABAニューロンを人為的に活性化したところ、水分摂取および塩分摂取が抑制され、その抑制効果は、LPBNのそれぞれのCckニューロンを活性化した時と同程度であったことから、LPBNCck→MnPOニューロンおよびLPBNCck→vBNSTニューロンはGABAニューロンの活性化を介して、水分摂取および塩分摂取を制御していると推定された(図3)。
最後に、化学遺伝学的手法[用語9]を用いて、脱水状態においてSFOのCCKニューロンとLPBNのCckニューロンの活動を同時に抑制したところ、一方のCckニューロンだけを抑制した時よりも水分摂取量が有意に増加した。この結果は、SFOのCCKニューロンとLPBNのCckニューロンが水分摂取の抑制に協調的に機能していることを示している。
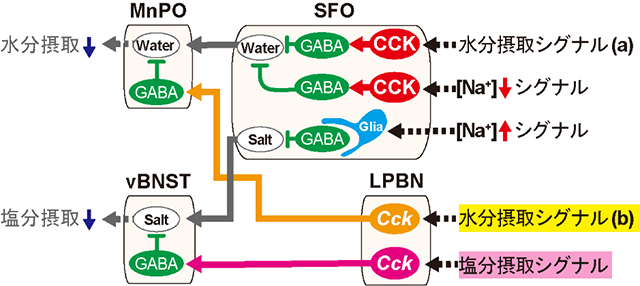
図3. 水分摂取および塩分摂取を抑制する神経回路の全体像。 黄色と赤色のシグナルの伝達機構が今回明らかになった。
今回の水分摂取および塩分摂取行動を制御する脳内機構の解明は、神経科学や生理学分野における重要な発見というだけでなく、多飲症や食塩の過剰摂取、食塩感受性高血圧症など水分および塩分摂取の異常により誘発される疾患の発症機序の解明および治療?予防法の確立にも貢献する知見であるといえる。
体液恒常性をつかさどる神経機構は生命維持において必須の機能であるが、いまだに多くの仕組みが未解明である。今後、MnPOやvBNSTに集積する水分摂取あるいは塩分摂取の誘導と抑制のシグナルが、どのような仕組みで統合されているのか明らかにする必要がある。
付記
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 チーム型研究(CREST)(野田昌晴:JPMJCR1754)およびJST創発的研究支援事業FOREST(松田隆志:JPMJFR226C)、日本学術振興会 科学研究費助成事業(野田昌晴:19H05659、松田隆志:18K14855, 21H05615, 22H02732)、時実利彦記念賞(野田昌晴)、公益財団法人ブレインサイエンス振興財団(松田隆志)、公益財団法人ソルト?サイエンス研究財団(松田隆志)、公益財団法人中島記念国際交流財団(松田隆志)、公益財団法人日本科学協会(松田隆志)、自然科学研究機構生理学研究所の計画共同研究(松田隆志)の支援を受けて行われた。
用語説明
[用語1] 外側腕傍核(LPBN) : 脳の橋と呼ばれる領域に存在する神経核。情報伝達の中継点として知られ、末梢から体温や味覚、痛覚などの感覚情報や体液調節のための情報を受け取ることが知られている。
[用語2] コレシストキニン(Cck) : 消化管ホルモンとしてタンパク質や脂肪の分解に関わることが知られている。一方で、脳神経系においても広く分布し、神経伝達物質として生理的な役割を果たしていることが知られている。
[用語3] 抑制性神経細胞(GABAニューロン) : 抑制性神経伝達物質であるGABAを分泌するGABA作動性ニューロン。Clイオン透過性を上昇させ細胞膜を過分極させることによって興奮性神経細胞からの出力を抑制する。
[用語4] 水ニューロン : 本研究グループが同定したSFOに局在する水分摂取行動を誘導する興奮性神経細胞の集団。ペプチドホルモンであるAng IIの受容体、AT1aを発現している。
[用語5] 塩ニューロン : 本研究グループが同定したSFOに局在する塩分摂取行動を誘導する興奮性神経細胞の集団。ペプチドホルモンであるAng IIの受容体、AT1aを発現している。
[用語6] アデノ随伴性ウイルスベクター : 非病原性ウイルスを用いて、標的細胞に目的遺伝子を遺伝子導入するように人工的に改良されたウイルスベクター。
[用語7] in vivoカルシウムイメージング : 生きた動物の標的細胞にカルシウムセンサータンパク質を導入することによって、細胞活動に連動して変化する細胞内カルシウム濃度を蛍光顕微鏡を用いて蛍光強度の変化として検出する。
[用語8] オプトジェネティクス : 光によって活性変化するタンパク質遺伝子を細胞に導入?発現させることで、その細胞機能を光によって人為的に操作する技術。神経細胞を活性化させる実験では、青色光によって活性化する陽イオンチャンネルであるチャネルロドプシン(ChR2)などが使用される。神経細胞の活動を抑制する実験では、黄色光によって活性化するクロライド(Cl-)ポンプであるハロロドプシン(eNpHR)などが使われる。
[用語9] 化学遺伝学的手法 : 神経細胞の活動を人為的に活性化あるいは抑制するため、人工受容体を神経細胞に遺伝子導入し、人工作動薬(化学物質)の投与によって神経活動を制御する技術。
参考文献
[1] Shimizu, H., Watanabe, E., Hiyama, T.Y., Nagakura, A., Fujikawa, A., Okado, H., Yanagawa, Y., Obata, K. and Noda, M. (2007). Glial Nax channels control lactate signaling to neurons for brain [Na+] sensing. Neuron. 54, 59-72.
[2] Matsuda, T., Hiyama, T.Y., Niimura, F., Matsusaka, T., Fukamizu, A., Kobayashi, K., Kobayashi, K., and Noda, M. (2017). Distinct neural mechanisms for the control of thirst and salt appetite in the subfornical organ. Nature Neuroscience. 20, 230-241.
[3] Matsuda, T., Hiyama, T.Y., Kobayashi, K., Kobayashi, K., and Noda, M. (2020). Distinct CCK-positive SFO neurons are involved in persistent or transient suppression of water intake. Nature Communications. 11, 5692.
論文情報
掲載誌 : |
Cell Reports |
論文タイトル : |
Two parabrachial Cck neurons involved in the feedback control of thirst or salt appetite (2種類の外側腕傍核のCckニューロンが担う水分欲求および塩分欲求を抑制するフィードバック制御機構) |
著者 : |
Takashi Matsuda, Kenta Kobayashi, Kazuto Kobayashi, Masaharu Noda* (*corresponding author) |
DOI : |
お問い合わせ先
東京工業大学 科学技術創成研究院 生体恒常性研究ユニット
特任教授 野田昌晴
Email noda.m.ae@m.titech.ac.jp
Tel 045-924-5537 / Fax 045-924-5538
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661